La vacuna Covid-19 de Pfizer y su socio BioNTech fue la primera en obtener el permiso del gobierno federal para entrar en uso en los Estados Unidos, un paso histórico en los esfuerzos por hacer retroceder la terrible pandemia, según publica el Wall Street Journal.
La autorización de la vacuna por la Administración de Drogas y Alimentos de los Estados Unidos(FDA) el viernes, luego de su rápido desarrollo récord, prepara el escenario para que la administración de las vacunas que comenzó este lunes.
La decisión autoriza el uso de las inyecciones en personas mayores de 16 años, incluidos los ancianos.
El presidente Trump, en un video publicado en Twitter el viernes por la noche, llamó a la vacuna un "milagro médico".
“Este es uno de los mayores logros científicos de la historia”, dijo, hablando desde la Oficina Oval. "Salvará millones de vidas y pronto acabará con la pandemia de una vez por todas".
El presidente dijo que la vacuna es segura y gratuita para todos los estadounidenses.
La primera luz verde de la FDA para una vacuna Covid-19 llega poco más de una semana después de una autorización similar en el Reino Unido.
Todo esto después de un estudio de 44,000 personas, que encontró que la inyección fue 95% efectiva para prevenir el Covid-19 sintomático y en general fue seguro.
Ahora, EUA comienza la campaña de vacunación más grande de su historia, que reúne a gobiernos, hospitales pequeños y grandes, así como a cadenas de farmacias minoristas con el objetivo de vacunar rápidamente a cientos de millones de personas.
La abrumadora tarea incluirá la distribución de una vacuna que debe almacenarse a temperaturas extremadamente frías y, dado que la inoculación requiere dos dosis con tres semanas de diferencia, el desafío de garantizar que las personas regresen para recibir una vacuna de refuerzo. También significa convencer a la gran cantidad de estadounidenses que dudan en vacunarse de que la vacuna es segura.
Los suministros iniciales serán limitados, Pfizer planea distribuir alrededor de 25 millones de dosis en EUA antes de fin de año, potencialmente suficiente para 12,5 millones de personas porque la vacuna requiere dos dosis.
La mayoría de los estadounidenses no podrían vacunarse antes de la primavera o el verano, porque Pfizer necesita tiempo para producir las dosis suficientes.
Si un número suficiente de personas finalmente se ponen las inyecciones, las escuelas, los negocios y los restaurantes podrían comenzar a reabrir por completo.
El impacto de una vacuna se produce no solo si es eficaz en un individuo, sino también si se toma ampliamente.
“La autorización de la FDA para el uso de emergencia de la primera vacuna Covid-19 es un hito importante en la lucha contra esta devastadora pandemia que ha afectado a tantas familias en los Estados Unidos y en todo el mundo”, dijo el comisionado de la FDA Stephen Hahn.
Al anunciar la autorización, la FDA advirtió que es posible que la vacuna no proteja a todos los que la reciben.
La agencia también dijo que los médicos y enfermeras que administran la inyección deben tener a mano tratamientos para controlar las reacciones alérgicas inmediatas.
Los materiales de la FDA para médicos y enfermeras dicen que la vacuna no debe administrarse a personas con antecedentes conocidos de una reacción alérgica grave a cualquier componente de la vacuna.
Las autoridades sanitarias del Reino Unido advirtieron recientemente contra la administración de la vacuna a personas con antecedentes de reacciones alérgicas graves, después de que dos trabajadores del servicio de salud sufrieran las reacciones después de vacunarse. Los investigadores excluyeron a las personas con reacciones alérgicas graves a las vacunas del estudio de última etapa de la inyección Pfizer-BioNTech.
La FDA también dijo que la vacuna podría no ser tan fuerte en personas con sistemas inmunológicos comprometidos, incluidos aquellos que toman medicamentos que debilitan el sistema inmunológico.
Desde que el Covid-19 inundó hospitales y hundió la economía, las autoridades sanitarias, los funcionarios gubernamentales y los líderes empresariales han esperado la llegada de las vacunas y su potencial para erradicar el virus.
Por lo general, las vacunas tardan años en crearse, probarse y comercializarse. Pfizer y BioNTech estuvieron entre las docenas de fabricantes de medicamentos que se lanzaron a la acción.
“Hemos trabajado incansablemente para hacer posible lo imposible, firmes en nuestra creencia de que la ciencia ganará”, dijo el presidente ejecutivo de Pfizer, Albert Bourla.
No muy atrás están Moderna Inc., que tiene la oportunidad de obtener la autorización de la FDA en tan solo una semana, y varios otros fabricantes de medicamentos con candidatos en las últimas etapas de desarrollo.
Las inyecciones desarrolladas en China y Rusia ya se han utilizado en esos países y en otros.
El desarrollo y la autorización de la vacuna de Pfizer y BioNTech avanzó más rápido de lo que ha avanzado cualquier inyección en Occidente, en menos de un año. Anteriormente, una vacuna contra las paperas había sido la más rápida de comercializarse, demorando unos cuatro años.
"Es increíble lo rápido que fue la autorización", dijo el director ejecutivo de BioNTech, Ugur Sahin.
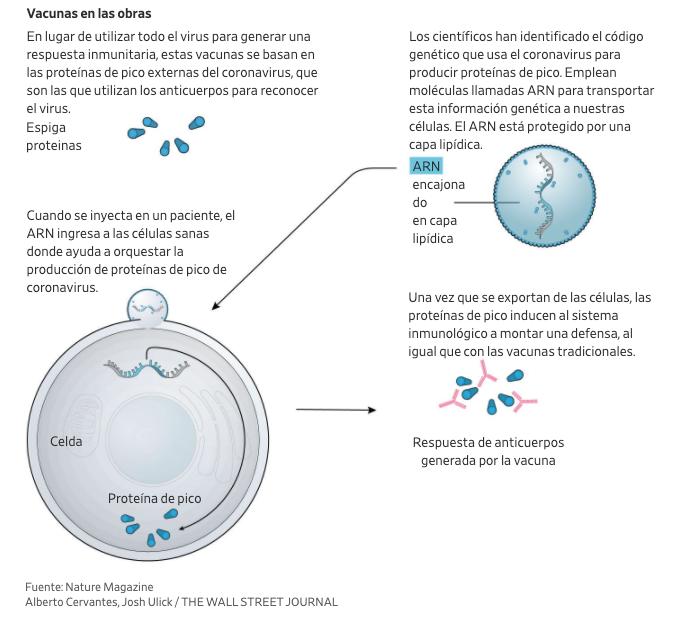
Pfizer y BioNTech se movieron rápidamente al recurrir a una tecnología basada en genes prometedora pero no probada , conocida como ARN mensajero por las moléculas que llevan a las células las instrucciones del ADN para producir proteínas.
La vacuna de Moderna también emplea tecnología de ARNm.
Usando la secuencia genética del coronavirus, los investigadores de BioNTech sintetizaron ARNm que enseñaría a las células a hacer una versión de la proteína de pico que sobresale del coronavirus. La producción de la proteína impulsa al sistema inmunológico a desarrollar defensas que se movilicen contra el virus real.
Dada la urgente necesidad de una vacuna, la FDA tomó su decisión en unas semanas, una fracción de los meses que normalmente se necesitan para considerar una solicitud. Técnicamente, la agencia otorgó una autorización temporal, conocida como autorización para uso de emergencia.
La FDA dijo que aún mantenía la vacuna con los altos estándares que habría exigido si no hubiera habido una pandemia.
La agencia ha emitido autorizaciones de uso de emergencia , que son diferentes a una aprobación normal, durante los últimos meses para varios medicamentos, aunque no una vacuna hasta ahora.
Peter Marks, director de la división de la FDA que revisa las vacunas, dijo que "los esfuerzos para acelerar el desarrollo de vacunas no han sacrificado los estándares científicos ni la integridad de nuestro proceso de evaluación de vacunas".
El gobierno de Estados Unidos realizó un pedido inicial de 100 millones de dosis de la vacuna Pfizer-BioNTech por casi $2 mil millones, con la opción de comprar 500 millones de dosis adicionales.
Pfizer ha estado produciendo inyecciones en plantas de Bélgica y Michigan. Para prepararse para la distribución de las dosis, la empresa envió alrededor de 750.000 vacunas desde su planta de Bélgica a EE. UU.
El gobierno federal decide la cantidad de suministros de vacunas que recibirán los estados, según el tamaño de sus poblaciones. Los estados y otras jurisdicciones recibirán inicialmente 2.9 millones de dosis de Pfizer, con 2.9 millones adicionales tres semanas después para la segunda dosis. Le seguirían envíos semanales de dosis.
Los estados, así como algunos territorios, las agencias de salud federales y las grandes ciudades, determinarán dónde se administrarán los millones de vacunas y quién debe vacunarse primero. Los hospitales, las clínicas de salud y ciertos lugares de salud pública servirán inicialmente como la mayoría de los sitios de vacunación. Las farmacias podrán administrar vacunas a medida que se preparen más dosis y más personas puedan tener acceso.
Cómo funcionan las vacunas de ARN mensajero
La vacuna de Pfizer y BioNTech utiliza una nueva tecnología basada en genes conocida como ARNm.

“A medida que los estadounidenses se vacunan, debemos continuar tomando medidas como lavarnos las manos, distanciarnos socialmente y usar mascarillas para protegernos a nosotros mismos, a nuestros seres queridos y a nuestras comunidades”, dijo el secretario de Salud y Servicios Humanos, Alex Azar, en un comunicado.
Los Centros para el Control y la Prevención de Enfermedades de EE. UU. Recomendaron que los 21 millones de trabajadores de la salud del país y los tres millones de residentes de hogares de ancianos y otros residentes de cuidados a largo plazo sean los primeros en recibir cualquier dosis de la vacuna Covid-19. Los estados no tienen que seguir las pautas de los CDC.
Las farmacias de CVS Health Corp. y Walgreens Boots Alliance Inc. entregarán y administrarán la mayoría de las dosis de vacunas para los aproximadamente 15,600 hogares de ancianos y 29,000 comunidades de vida asistida del país, una vez que los estados den el visto bueno.
McKesson Corp., que distribuirá vacunas distintas a las de Pfizer, ha estado enviando a hospitales y otros sitios de administración kits con jeringas, toallitas de preparación con alcohol y otros suministros médicos necesarios para administrar la vacuna Covid-19 de Pfizer.
Las autoridades sanitarias no esperan que haya suficiente suministro para vacunar a la población en general hasta la primavera o el verano del próximo año. Para entonces, las vacunas de AstraZeneca PLC, Johnson & Johnson y otras compañías podrían estar autorizadas y aumentar los suministros.
No está claro qué tan pronto comenzarán las vacunas con los suministros iniciales. Una vez que una vacuna llega a un hospital, podría comenzar a administrarse inyecciones en cuestión de horas, dicen los expertos en vacunas, aunque también podrían pasar días mientras los trabajadores del hospital aprenden a manejar los envases que almacenan las inyecciones a temperaturas ultra frías.
Un gran desafío es persuadir a millones de personas para que se vacunen. Las encuestas han encontrado que un gran porcentaje de personas en los EE. UU., Muchas de las cuales están en categorías de alto riesgo, dudan en vacunarse, en parte debido a la preocupación de que el desarrollo de las vacunas se apresuró.
Las propias acciones y comentarios de la administración Trump han alimentado algunas de las dudas, según las encuestas.
Durante la campaña presidencial, Trump instó a la FDA a autorizar una vacuna antes del día de las elecciones. También dijo que durante el primer debate presidencial y en una conferencia de prensa en septiembre, una vacuna estaría disponible en unas semanas.
La FDA y los funcionarios de la industria hicieron declaraciones buscando aliviar cualquier preocupación de que la presión política los estuviera obligando a disparar .
La FDA también publicó pautas detalladas que describen los requisitos de la agencia para autorizar una vacuna .



